康宁生命科学 (吴江) 有限公司品牌商
9 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
细胞迁移与侵袭实验常见问题
8618 人阅读发布时间:2020-01-19 10:10
细胞迁移与侵袭实验常见问题
⚑ 细胞迁移与侵袭实验有什么区别?
细胞迁移是细胞在化学信号(如:趋化因子)的驱使下沿着浓度梯度从一个区域转移到另一区域的运动。损伤修复、细胞分化、胚胎发育以及恶性肿瘤转移等诸多生理/病理过程都需要通过细胞迁移来完成。
细胞侵袭与细胞迁移比较类似,但是“侵袭”需要细胞穿过胞外基质层(ECM)或基底膜基质层(BME),在这个过程中细胞先酶解去除ECM/BME的阻碍,从而在趋化因子浓度梯度驱使下完成从一处到另一处的移动。细胞侵袭可以发生在正常细胞的炎症反应过程中,也常发生在恶性肿瘤细胞的转移过程中。因此,研究其中的机制对多种生理/病理过程都有着重要的意义。
⚑ 迁移、侵袭实验的大致步骤是怎样的?
Corning的Transwell小室产品(以及我司旗下Falcon品牌的Insert小室产品)可为迁移、侵袭实验构建绝佳的研究模型。您可将待研究的细胞接种在Transwell/Insert小室的微孔膜上,在上下室分别加入含有不同浓度的趋化因子的培养基;细胞在迁移、侵袭实验时,受到趋化因子的吸引,会挤压自身以穿过膜上的小孔,并在膜的背侧贴附下来。实验结束后,您可统计穿过膜的细胞的情况来评价迁移/侵袭实验。
与迁移实验不同的是,侵袭实验中需要在微孔膜上额外包被一些基质蛋白(ECM/BME),如胶原、纤粘蛋白、层粘连蛋白等,CorningMatrigel产品也被非常广泛地应用在侵袭实验中。
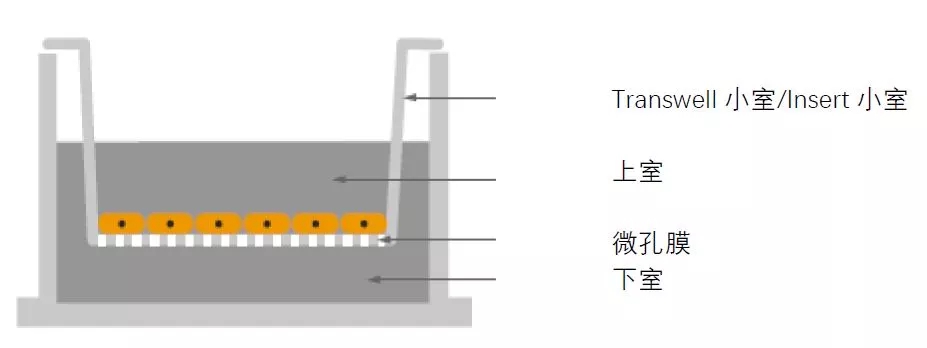
⚑ 如何选择用于迁移/侵袭实验的产品?
Corning品牌Transwell小室主要的两种膜材质聚碳酸酯(Polycarbonate, PC)和聚酯(Polyesteror Polyethylene Terephthalate,PET)均可用于迁移、侵袭实验。
Falcon品牌的Insert产品膜材质均为聚酯(PET)。
两种材质的主要区别在光透性方面,即PC膜半透明,不太方便在培养的过程中观察上室细胞的形态;PET膜透明,方便在相差显微镜下观察细胞的状态。您可根据是否有需要观察细胞状态来挑选膜材质。请注意Falcon品牌的Insert产品膜材质虽然均为聚酯(PET),但是针对孔密度的不同而分为透明膜及半透明膜两种。
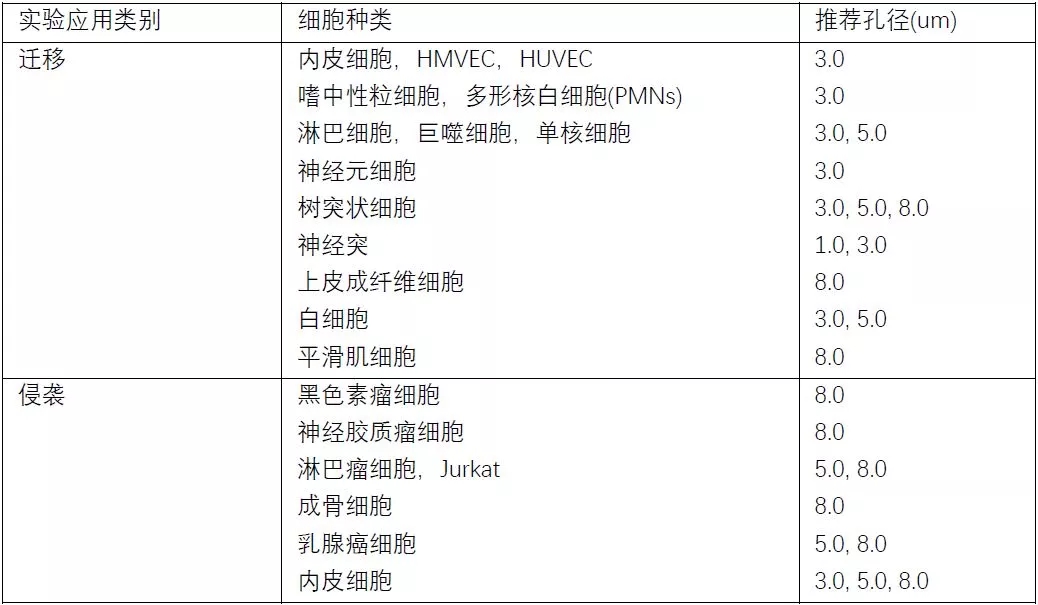
在膜孔径的选择方面,需要根据您所研究的细胞种类来决定,下表为一些常见细胞种类进行迁移、侵袭实验的孔径推荐,供您参考,同时也可以参考已发表的相关文献来辅助您的判断。目前我司提供的小室产品最大孔径为8um,能够满足大多数较大细胞(如多数肿瘤细胞)迁移、侵袭实验的需求。(对于一些要求严格的实验,我们建议在正式实验前选取一系列孔径进行预实验来确定最适合于您的细胞培养和特殊应用的尺寸。)
在进行侵袭实验时,如选用Matrigel来进行小室的包被,在没有特殊要求的情况下(如:酚红不会影响您的实验和后续检测),标准浓度的Matrigel产品便可满足您的需要。(如Corning货号356234—5ml规格/354234—10ml规格。如您的研究涉及生长因子及其相关信号通路,您可选择生长因子减量型GFRMatrigel。)由于侵袭实验中需要用到的Matrigel终浓度并不高(一般为200-300ug/ml),高浓度的Matrigel产品非常粘稠,在稀释时容易造成浓度不准确,可能会影响您的实验结果,因此不推荐使用高浓度Matrigel产品进行侵袭实验。
我司亦有预包被了Matrigel 的小室产品出售,Corning® BioCoat™ Matrigel® Invasion Chamber 354480/354481/354483。
⚑ 在进行细胞侵袭实验时,如何包被小室?
准备包被小室的Matrigel可使用冰上预冷的无血清培养基或phosphate-bufferedsaline (PBS), pH 7.4稀释(关于Matrigel的使用您可参考Matrigel相关技术文档)。大多数情况下,您可使用培养实验细胞的同种培养基(无血清)。
我司推荐的Matrigel包被浓度为200~300ug/ml。不同板式的小室包被量可参考下表:
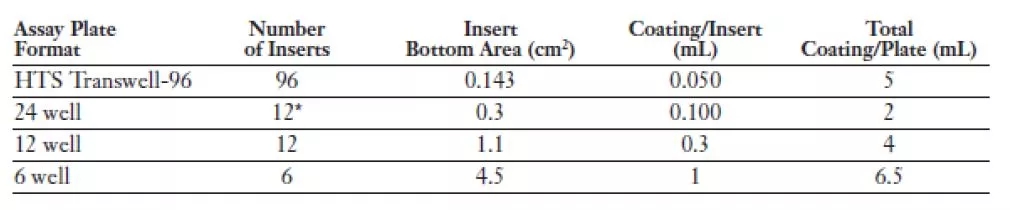
您可根据您的细胞种类、侵袭能力等优化Matrigel包被浓度,并通过预实验进行验证。在稀释到所需浓度后,您可使用预冷的吸头将Matrigel稀释液加入小室中,再将小室连同接收板一并放入37°C细胞培养箱中1~2小时,包被即完成。由于侵袭实验所需要的Matrigel稀释液终浓度不会大于Matrigel的成胶浓度,因此,包被完成后,您并不会观察到小室内有一厚层果冻状的凝胶。您可将小室稍稍倾斜,用吸头小心吸去上室内多余的包被液(请勿触碰小室底部,以免破坏膜上包被好的Matrigel)。包被好的小室即可接种细胞了。推荐您在包被的当天使用包被好的小室。
⚑ 水化(Rehydration)是个什么步骤?我需要对包被好的小室进行“水化”吗?
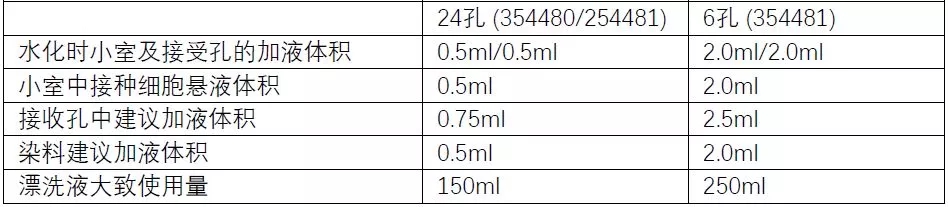
水化步骤仅适用于预包被Matrigel的侵袭小室产品,Corning® BioCoat™ Matrigel® Invasion Chamber 354480/354481/354483。在将预包被Matrigel的侵袭小室从冰箱中取出,除去包装并平衡到室温后,您需要向小室内和接收板的孔中加入温热的无血清培养基(加液体积请参考下表),在37°C细胞培养箱中水化约2小时。之后,请小心去除多余的培养基(请勿触碰小室底部,以免破坏膜上包被好的Matrigel)。
如果您是自行包被的小室,包被好的小室即可接种细胞,不需要进行额外的“水化”步骤。
⚑ 我需要在小室内接种多少细胞?
这需要根据您使用的细胞种类和状态进行优化,下表为我司的推荐用量,供您参考,您可在推荐量上下设计梯度以选取最适合您实验的细胞接种数量。
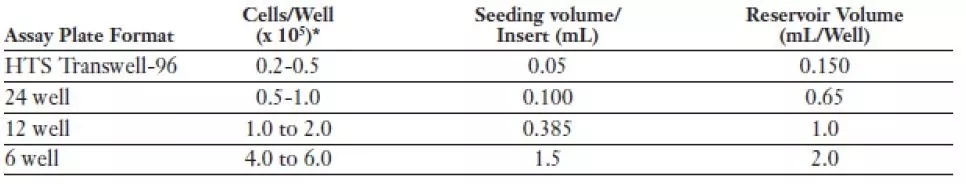
⚑ 迁移/侵袭实验需要进行多长时间?
在许多情况下,迁移实验所需的时间相对侵袭实验短,可能数小时便可得到所需结果,而侵袭实验一般需要相对长的时间,如24小时、甚至48小时。但是迁移/侵袭实验所需的时间与多方面因素有关,如诱导因子的种类、浓度,细胞的性质,基质蛋白屏障的包被浓度和“用量“(仅针对侵袭实验)等。因此,进行预实验来优化迁移/侵袭实验时间非常关键。
需要注意的是,迁移实验的孵育时间越长,细胞自发进行转移的情况会相应增多;另外,如果实验进行的时间过长,也需要考虑细胞生长状态以及增殖的因素,这些都会影响实验的结果。
⚑ 在迁移/侵袭实验孵育结束后,应进行哪些操作?
首先弃去小室内的液体,接着,您可使用培养基或PBS湿润过的棉签倾斜着擦拭小室膜的上层,以去除未发生迁移/侵袭的细胞。当棉签头在膜表面移动时,请对膜施加轻柔但持续的压力。请小心操作,勿破坏膜和小室结构,同时,由于小室膜底部与接收板的距离并不大,请您留意勿使膜接触孔底,破坏迁移/侵袭到背侧的细胞。随后,使用第二支棉签重复擦拭并用洗液洗涤上室。
如您采用染色的方式检测实验结果,您可在擦拭过后使用常见的多种细胞固定液和染色试剂,或是商品化的试剂盒,对穿膜的细胞进行固定和染色的操作。请您依据相应试剂供应商的使用说明进行操作。最后,将小室风干,便可以在显微镜下观察、计数细胞。
⚑ 为何我在镜下观察到穿膜细胞的分布在膜周围一圈和(或)膜中间与其他位置有明显不同?
在一些情况下,某些细胞确实会倾向于从周围和/或中间部位迁移,因此造成在这些区域的穿膜细胞相对其他区域密集。您可以尽可能选取多个视野,并设置平行复孔,以获得能更“准确”代表细胞迁移/侵袭情况的数据。
此外,如果出现区块间细胞分布过于悬殊的状况,可能有其他原因,如细胞接种不均匀,包被的Matrigel层被部分破坏,擦拭细胞或其他操作时的误损伤等。
⚑ 实验结果应如何统计?
您可根据多个视野内迁移/侵袭细胞计数,镜下视野的大小以及膜面积,折算出单个小室膜上发生迁移/侵袭的细胞量,与总接种细胞量比较,得到单个小室的迁移/侵袭率。之后可继续进行您的各个处理组内及组间的计算和比较。
此外,在侵袭实验中,推荐您设置一组未包被胞外基质的”迁移组“,作为整个侵袭系统的参照。亦可计算各处理组发生侵袭的细胞平均数与参照组发生迁移的细胞平均数的比值作为侵袭率的统计方式。
⚑ 小室的膜可以封片保存吗?
可以。您可使用锋利的手术刀片沿着膜与小室侧壁连接的边缘将膜切下,请在即将完全切下时留下很小的附着点,使用镊子从小室上将膜取下,将其底部向下放置在已滴好一小滴浸镜油(或其他封片试剂)的载玻片上,接着再在膜上滴一小滴浸镜油,覆上另一块载玻片或是盖玻片,轻轻施加一定压力以驱赶气泡。
⚑ 悬浮细胞是否可进行迁移/侵袭实验?
可以。悬浮细胞在诱导因子的趋使下穿过膜上的孔后会落至下室。您可以收集接收板内的细胞,使用血球计数仪,流式细胞仪或其他染色的方式(如MTT,荧光染色等)进行计数。
⚑ 在侵袭实验结束后,我在镜下完全观察不到穿膜的细胞,请问是怎么回事?
侵袭实验不成功的原因可能有很多种,除了误操作以外,以下一些可能的方面供您参考:
⚑ 我可以使用其他的计数迁移/侵袭细胞的方法吗?
除了染色和显微镜下计数以外,您可以使用多种试剂分离细胞并计数;或使用染色、脱色、检测脱色液的OD值的方式间接反映细胞数;亦可使用钙黄绿素等多种荧光染料对细胞染色后在读板机上读取荧光值(需使用FluoroBlok小室)。
⚑ 细胞迁移与侵袭实验有什么区别?
细胞迁移是细胞在化学信号(如:趋化因子)的驱使下沿着浓度梯度从一个区域转移到另一区域的运动。损伤修复、细胞分化、胚胎发育以及恶性肿瘤转移等诸多生理/病理过程都需要通过细胞迁移来完成。
细胞侵袭与细胞迁移比较类似,但是“侵袭”需要细胞穿过胞外基质层(ECM)或基底膜基质层(BME),在这个过程中细胞先酶解去除ECM/BME的阻碍,从而在趋化因子浓度梯度驱使下完成从一处到另一处的移动。细胞侵袭可以发生在正常细胞的炎症反应过程中,也常发生在恶性肿瘤细胞的转移过程中。因此,研究其中的机制对多种生理/病理过程都有着重要的意义。
⚑ 迁移、侵袭实验的大致步骤是怎样的?
Corning的Transwell小室产品(以及我司旗下Falcon品牌的Insert小室产品)可为迁移、侵袭实验构建绝佳的研究模型。您可将待研究的细胞接种在Transwell/Insert小室的微孔膜上,在上下室分别加入含有不同浓度的趋化因子的培养基;细胞在迁移、侵袭实验时,受到趋化因子的吸引,会挤压自身以穿过膜上的小孔,并在膜的背侧贴附下来。实验结束后,您可统计穿过膜的细胞的情况来评价迁移/侵袭实验。
与迁移实验不同的是,侵袭实验中需要在微孔膜上额外包被一些基质蛋白(ECM/BME),如胶原、纤粘蛋白、层粘连蛋白等,CorningMatrigel产品也被非常广泛地应用在侵袭实验中。

⚑ 如何选择用于迁移/侵袭实验的产品?
Corning品牌Transwell小室主要的两种膜材质聚碳酸酯(Polycarbonate, PC)和聚酯(Polyesteror Polyethylene Terephthalate,PET)均可用于迁移、侵袭实验。
Falcon品牌的Insert产品膜材质均为聚酯(PET)。
两种材质的主要区别在光透性方面,即PC膜半透明,不太方便在培养的过程中观察上室细胞的形态;PET膜透明,方便在相差显微镜下观察细胞的状态。您可根据是否有需要观察细胞状态来挑选膜材质。请注意Falcon品牌的Insert产品膜材质虽然均为聚酯(PET),但是针对孔密度的不同而分为透明膜及半透明膜两种。
在膜孔径的选择方面,需要根据您所研究的细胞种类来决定,下表为一些常见细胞种类进行迁移、侵袭实验的孔径推荐,供您参考,同时也可以参考已发表的相关文献来辅助您的判断。目前我司提供的小室产品最大孔径为8um,能够满足大多数较大细胞(如多数肿瘤细胞)迁移、侵袭实验的需求。(对于一些要求严格的实验,我们建议在正式实验前选取一系列孔径进行预实验来确定最适合于您的细胞培养和特殊应用的尺寸。)

在进行侵袭实验时,如选用Matrigel来进行小室的包被,在没有特殊要求的情况下(如:酚红不会影响您的实验和后续检测),标准浓度的Matrigel产品便可满足您的需要。(如Corning货号356234—5ml规格/354234—10ml规格。如您的研究涉及生长因子及其相关信号通路,您可选择生长因子减量型GFRMatrigel。)由于侵袭实验中需要用到的Matrigel终浓度并不高(一般为200-300ug/ml),高浓度的Matrigel产品非常粘稠,在稀释时容易造成浓度不准确,可能会影响您的实验结果,因此不推荐使用高浓度Matrigel产品进行侵袭实验。
我司亦有预包被了Matrigel 的小室产品出售,Corning® BioCoat™ Matrigel® Invasion Chamber 354480/354481/354483。
⚑ 在进行细胞侵袭实验时,如何包被小室?
准备包被小室的Matrigel可使用冰上预冷的无血清培养基或phosphate-bufferedsaline (PBS), pH 7.4稀释(关于Matrigel的使用您可参考Matrigel相关技术文档)。大多数情况下,您可使用培养实验细胞的同种培养基(无血清)。
我司推荐的Matrigel包被浓度为200~300ug/ml。不同板式的小室包被量可参考下表:

您可根据您的细胞种类、侵袭能力等优化Matrigel包被浓度,并通过预实验进行验证。在稀释到所需浓度后,您可使用预冷的吸头将Matrigel稀释液加入小室中,再将小室连同接收板一并放入37°C细胞培养箱中1~2小时,包被即完成。由于侵袭实验所需要的Matrigel稀释液终浓度不会大于Matrigel的成胶浓度,因此,包被完成后,您并不会观察到小室内有一厚层果冻状的凝胶。您可将小室稍稍倾斜,用吸头小心吸去上室内多余的包被液(请勿触碰小室底部,以免破坏膜上包被好的Matrigel)。包被好的小室即可接种细胞了。推荐您在包被的当天使用包被好的小室。
⚑ 水化(Rehydration)是个什么步骤?我需要对包被好的小室进行“水化”吗?
水化步骤仅适用于预包被Matrigel的侵袭小室产品,Corning® BioCoat™ Matrigel® Invasion Chamber 354480/354481/354483。在将预包被Matrigel的侵袭小室从冰箱中取出,除去包装并平衡到室温后,您需要向小室内和接收板的孔中加入温热的无血清培养基(加液体积请参考下表),在37°C细胞培养箱中水化约2小时。之后,请小心去除多余的培养基(请勿触碰小室底部,以免破坏膜上包被好的Matrigel)。

如果您是自行包被的小室,包被好的小室即可接种细胞,不需要进行额外的“水化”步骤。
⚑ 我需要在小室内接种多少细胞?
这需要根据您使用的细胞种类和状态进行优化,下表为我司的推荐用量,供您参考,您可在推荐量上下设计梯度以选取最适合您实验的细胞接种数量。

⚑ 迁移/侵袭实验需要进行多长时间?
在许多情况下,迁移实验所需的时间相对侵袭实验短,可能数小时便可得到所需结果,而侵袭实验一般需要相对长的时间,如24小时、甚至48小时。但是迁移/侵袭实验所需的时间与多方面因素有关,如诱导因子的种类、浓度,细胞的性质,基质蛋白屏障的包被浓度和“用量“(仅针对侵袭实验)等。因此,进行预实验来优化迁移/侵袭实验时间非常关键。
需要注意的是,迁移实验的孵育时间越长,细胞自发进行转移的情况会相应增多;另外,如果实验进行的时间过长,也需要考虑细胞生长状态以及增殖的因素,这些都会影响实验的结果。
⚑ 在迁移/侵袭实验孵育结束后,应进行哪些操作?
首先弃去小室内的液体,接着,您可使用培养基或PBS湿润过的棉签倾斜着擦拭小室膜的上层,以去除未发生迁移/侵袭的细胞。当棉签头在膜表面移动时,请对膜施加轻柔但持续的压力。请小心操作,勿破坏膜和小室结构,同时,由于小室膜底部与接收板的距离并不大,请您留意勿使膜接触孔底,破坏迁移/侵袭到背侧的细胞。随后,使用第二支棉签重复擦拭并用洗液洗涤上室。
如您采用染色的方式检测实验结果,您可在擦拭过后使用常见的多种细胞固定液和染色试剂,或是商品化的试剂盒,对穿膜的细胞进行固定和染色的操作。请您依据相应试剂供应商的使用说明进行操作。最后,将小室风干,便可以在显微镜下观察、计数细胞。
⚑ 为何我在镜下观察到穿膜细胞的分布在膜周围一圈和(或)膜中间与其他位置有明显不同?
在一些情况下,某些细胞确实会倾向于从周围和/或中间部位迁移,因此造成在这些区域的穿膜细胞相对其他区域密集。您可以尽可能选取多个视野,并设置平行复孔,以获得能更“准确”代表细胞迁移/侵袭情况的数据。
此外,如果出现区块间细胞分布过于悬殊的状况,可能有其他原因,如细胞接种不均匀,包被的Matrigel层被部分破坏,擦拭细胞或其他操作时的误损伤等。
⚑ 实验结果应如何统计?
您可根据多个视野内迁移/侵袭细胞计数,镜下视野的大小以及膜面积,折算出单个小室膜上发生迁移/侵袭的细胞量,与总接种细胞量比较,得到单个小室的迁移/侵袭率。之后可继续进行您的各个处理组内及组间的计算和比较。
此外,在侵袭实验中,推荐您设置一组未包被胞外基质的”迁移组“,作为整个侵袭系统的参照。亦可计算各处理组发生侵袭的细胞平均数与参照组发生迁移的细胞平均数的比值作为侵袭率的统计方式。
⚑ 小室的膜可以封片保存吗?
可以。您可使用锋利的手术刀片沿着膜与小室侧壁连接的边缘将膜切下,请在即将完全切下时留下很小的附着点,使用镊子从小室上将膜取下,将其底部向下放置在已滴好一小滴浸镜油(或其他封片试剂)的载玻片上,接着再在膜上滴一小滴浸镜油,覆上另一块载玻片或是盖玻片,轻轻施加一定压力以驱赶气泡。
⚑ 悬浮细胞是否可进行迁移/侵袭实验?
可以。悬浮细胞在诱导因子的趋使下穿过膜上的孔后会落至下室。您可以收集接收板内的细胞,使用血球计数仪,流式细胞仪或其他染色的方式(如MTT,荧光染色等)进行计数。
⚑ 在侵袭实验结束后,我在镜下完全观察不到穿膜的细胞,请问是怎么回事?
侵袭实验不成功的原因可能有很多种,除了误操作以外,以下一些可能的方面供您参考:
- 是否选择了正确的孔径;
- 是否选择了正确的诱导因子,诱导因子的使用浓度是否足够有效;(不少情况下您可通过预先饥饿细胞,以增强其对于诱导因子如血清的敏感程度。)
- 是否设有系统对照;(如未包被的迁移组,迁移组的结果可帮助分析侵袭实验不成功的原因。)
- 细胞状态是否正常,是否有过研究表明其具有侵袭能力;
- 细胞接种密度是否合适;
- 胞外基质蛋白屏障的选择是否合适,包被浓度是否过高;(如您使用了较高浓度的Matrigel进行包被,甚至大于其成胶浓度3mg/ml,在包被结束后能观察到膜表面铺有一厚层果冻状的凝胶,则很大可能会由于细胞侵袭能力有限无法成功穿膜。)
- 加液时有否在膜下形成气泡;(气泡会对实验结果产生很大影响,您可在孵育开始后几小时再观察一次,以确认膜下没有小气泡汇聚形成大气泡。)
⚑ 我可以使用其他的计数迁移/侵袭细胞的方法吗?
除了染色和显微镜下计数以外,您可以使用多种试剂分离细胞并计数;或使用染色、脱色、检测脱色液的OD值的方式间接反映细胞数;亦可使用钙黄绿素等多种荧光染料对细胞染色后在读板机上读取荧光值(需使用FluoroBlok小室)。
为了更有效地帮助大家了解我们的产品、改善产品选择流程,同时解决可能出现的问题,我们技术部小姐姐特地针对咨询和疑问较多的产品,整理了一系列常见问题解答(FAQ)
传送门:
1. 快速了解如何选择/使用微孔板
2. 快速了解细胞培养耗材常见问题
3. Matrigel使用常见问题
4. 血清和其他细胞培养试剂常见问题
5. Transwell及Insert小室产品选择常见问题
6. 细胞迁移与侵袭实验常见问题
7. Axygen Biokit常见问题(上)
8. Axygen Biokit 常见问题(下)
9. Axygen 耗材常见问题
10. Axygen PCR耗材及密封产品常见问题
11. 移液管产品常见问题
12. 培养基选择及常见问题






